 收藏文章
收藏文章
2015年成人高考高起点《化学》模拟练习题和答案
1、氯气可用于自来水消毒和杀菌,下列试剂中,可以用来区分蒸馏水和用氯气消过毒的自来水的是: ( B )
A . 酚酞试液 B .酸性硝酸银溶液
C .淀粉溶液 D . 氢氧化钠溶液
解答:用氯气消毒过的的自来水的成分发生了改变,因为部分Cl2分子与水发生反应,生成盐酸和次氯酸(HClO)。
Cl2+H2O ==== HCl+HClO
次氯酸不稳定,易分解,放出氧气。当受到日光照射时,反应进行更快。
2HClO ==== 2HCl+O2↑
所以,氯水中含有氢离子、氯离子、次氯酸根离子;
蒸馏水中不含有杂质离子,所以,用鉴别银离子(氯离子)的方法比较方便,即用酸性硝酸银,能产生白色沉淀的是自来水。
答案:B
2. 把1L PH=10的氢氧化钠溶液加水稀释10 L,溶液的PH 为
A. 1 B . 8 C . 9 D . 11 ( C )
解答:pH的大小与氢离子浓度的大小有关:[H+][OH-]= Kw =1×10-14,
pH = -lg[H+],按此公式,氢离子浓度每减小10倍,pH即增大1倍,现在是氢氧根浓度减少了10倍,也即是氢离子浓度增大了10倍,pH应减小1
答案:C
3. 下列物质的水溶液中,氢离子浓度小于氢氧根浓度的是
A . NH4Cl B. NaHSO4 C. NaCl D. NaHCO3 ( D )
解答:四个物质中,A,C为正盐,其中A为强酸弱碱盐,水溶液显酸性;B、D 是酸式盐,其中,D为强碱弱酸盐,溶液显碱性,即溶液中氢离子浓度小于氢氧根离子浓度。
答案:D
4.乙醇脱水制乙烯 ,即其反应类型是
A. 取代反应 B .加成反应
C .消去反应 D .聚合反应 ( C )
解答:
分子内部脱掉一个水分子,这就是消去反应。
5.下列各组气体中,在常温下能稳定共存的是
A. H2 O2 SO2 B. NH3 O2 HCl
C. H2 F2 CO2 D. O2 CO NO ( A )
解答:应该是在常温常压下彼此不发生化学反应的一组,逐个分析
B中氨和氯化氢可以反应;C中氢气和氟可以反应;D中一氧化氮和氧气可以反应,所以,A为答案。
6.下列各组的物质,化学键类型相同的是
A. CaCl2和 SiO2 B . CO2和H2O
C. NaCl和HCl D. CCl4和KCl ( B )
解答:A中是离子键和共价键
B中都是共价键
C 和A一样
D CC14共价键、KCI是离子键
答案:B
7、下列反应达平衡后,增加压强和降低温度都能使平衡向正反应方向移动的是 (A )A. N2(g) + 3H2(g) 2NH3(g) (正反应是放热反应)
B. 2SO3(g) 2SO2(g) + O2(g) (正反应是吸热反应)
C. CaCO3(s) CO2 (g) + CaO(s) (正反应是吸热反应)
D. C(s)+ O2(g) 2CO(g) (正反应是放热反应)
解答:加压和降温对反应中有气体和有吸热放热的反应会有影响。加压,反应向着气体体积减小的方向移动;降温,反应向放热方向移动。这样就可以具体分析每一个反应,
A 反应前3个体积气体,反应后2个体积,加压有助于体积向缩小的方向进行,平衡向正反应方向移动;
B 体积情况的变化和A相反;
C CaCO3(s) 为固体,气体体积变化同B;
D 体积变化同A,但反应为吸热反应
答案:A
8.将一组物质放入水中生成白色沉淀,加入过量稀硝酸则沉淀全部溶解,并有气体生成,然后滴入硝酸银溶液又生成白色沉淀,该组物质是 ( B )
A. AgNO3 和 NaCl B. .CaCl2 和 K2CO3
C. Na2CO3 和Ba(OH)2 D.BaCl2 和Na2SO4
解答:倒推,一般与硝酸银反应产生白色沉淀的可能含有氯离子、碳酸根、硫酸根!这白色沉淀如遇强酸溶解的则是含碳酸根的(从有气体产生更加证明了)所以,答案:B
20 按系统命名法,有机化合物的名称_______
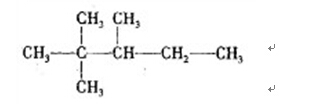
名称为2,2,3—三甲基戊烷 。
(从左边开始编号主碳链5个碳,2号碳上有两个甲基,3号碳上有一个甲基,一共3个甲基)
21.在HF HCl HBr和 HI四种化合物,还原性最强的是 ______HI
22. 某酯在酸性条件发生水解,生成甲酸和乙醇,该酯的结构简式是__________HCOOCH2CH3
23. 用导线把锌片和铜片连接后,浸入稀硫酸溶液中构成原电池,一段时间后,锌片质量减少了3.25g。铜片表面生成氢气_____L(标准状况下) 1.12升
解答:写出反应式,配平,找出比例关系;消耗的锌片质量折合为多少摩尔的锌(物质的量),产生相应多少摩尔的氢气,在标准状况下占有多少体积。
24. 在实验室里,分别制备氧气 氯气 甲烷和乙烯,其中制备_____可使用下图所示的实验装置
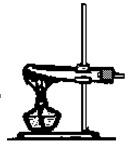
解答:此为固体通过加热方式产生气体的典型装置。
答案(氧气 甲烷)
25. 乙酸和氢氧化钠溶液反应,其离子方程为_______________
CH3COOH+OH-=CH3COO-+H2O
26. 在反应 3 Cu + 8 HNO3== 3Cu(NO3)2 + 2 NO↑ + 4 H2O
还原剂和还原产物分别是_____________
答案 (Cu NO)
27.某盐由一价阳离子和一价阴离子构成,该盐与盐酸反应,能产生无色无味并能使澄清石灰水变浑浊的气体,跟氢氧化钠溶液反应能产生有刺激性气味并能使湿润的红色石蕊试纸变成蓝色的气体,该盐的化学式是___________(NH4HCO3)
解答:第一句话判断气体是二氧化碳,说明盐中移动含有碳酸根;第二句话判断出是氨,说明盐中含有铵根,所以,此盐为碳酸铵。
28.元素X Y和 Z都位于短周期,它们的原子序数之和为 37,
X- 和 Y+具有相同的电子层结构并能生成离子化合物,则Y位于周期表________族,X的结构示意简图_________,Z与氢元素形成化合物的电子式为_________
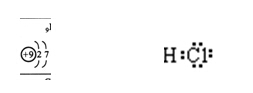
答案IA族
评论
全部评论(0)
还没有评论,快来抢沙发吧!